유럽 승인 기대, 일본 기술수출 및 아시아 임상 3상 가속화
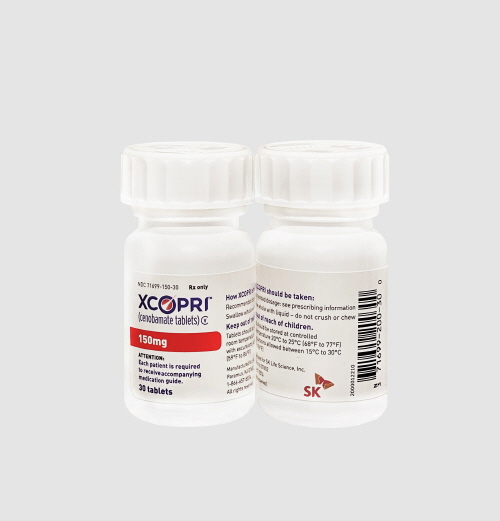
[매일일보 김동명 기자] SK바이오팜은 후보물질 발굴부터 글로벌 임상개발, 인허가 및 시판까지 전 과정을 국내 최초로 독자 수행한 혁신신약 세노바메이트(제품명 엑스코프리)가 21일로 미국 FDA(식품의약국) 승인 1주년을 맞았다고 23일 밝혔다.
SK바이오팜은 2001년부터 세노바메이트에 대한 연구를 시작했다. 2005년 FDA 임상시험 승인(IND) 이후 임상 1, 2상을 거쳐 2018년 글로벌 임상 3상을 완료했다. 같은 해 11월 21일 FDA에 신약 판매 허가를 신청했다. 2019년 11월 21일 시판 승인을 받은 세노바메이트는 SK바이오팜의 미국 법인 SK라이프사이언스 통해 2020년 5월 11일 세계 최대 뇌전증 시장인 미국에서 출시했다.
세노바메이트는 성인 대상 부분발작 치료제로, 임상시험에서 ‘발작 빈도 감소율’은 물론, ‘발작 완전 소실률(seizure freedom)’에서도 통계적 유의성을 인정받았다. 이러한 임상 데이터 기반으로 세노바메이트는 부분발작 뇌전증 환자들의 새로운 치료 옵션으로 큰 기대를 받고 있다.
약물 투약 기간 중에 발작이 발생하지 않는 ‘발작 완전 소실’은 환자의 일상이 정상으로 돌아간다는 것을 의미해, 삶의 질을 향상 시킬 수 있는 가장 중요한 요소이며 뇌전증 신약 선택에서 핵심적인 지표로 받아들여지고 있다.
지난 5월 세노바메이트를 세계 최대 제약시장인 미국에서 자력 출시한 이후 처방을 빠르게 확대하면서, 시장에서 주요 브랜드 제품으로 성장하고 있는 것으로 평가받고 있다. SK바이오팜 또한 신약 주권을 기반으로 한 글로벌 사업모델을 제시한 것으로 인정받고 있다.
SK바이오팜은 2019년 2월 세노바메이트의 유럽 지역 상업화를 위해 스위스 아벨 테라퓨틱스(Arvelle Therapeutics)와 기술수출 계약을 체결했고 유럽의약청(EMA)으로부터 신약 판매 허가 승인을 기다리고 있다.
조정우 SK바이오팜 사장은 “기존 약물을 복용함에도, 계속되는 발작으로 고통 받는 전세계 뇌전증 환자에게 세노바메이트가 ‘발작 완전 소실’이라는 차별적 가치를 제공하고 있어 기쁘다”며 “세노바메이트를 넘어 R&D 투자를 통해 신약을 지속적으로 창출해야 한다는 사명감을 갖고, 궁극적으로 사회적 가치의 지속 성장을 가능케 하는 글로벌 기업으로 발전해 나가겠다”라고 말했다.

좌우명 : 즐기려면 우선 관심을 가져라